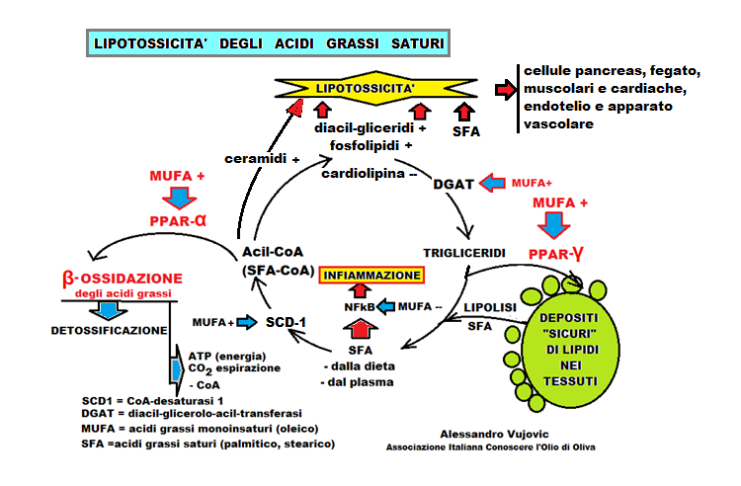
La ricerca ha dimostrato che gli acidi grassi saturi aumentano citotossicità da stress ossidativo, infiammazione e apoptosi. Ecco perchè l’American Heart Association raccomanda meno del 5% di grassi saturi.
di Alessandro Vujovic
Dopo gli studi, eseguiti negli anni ’60, su animali da esperimento, è stato appurato che gli acidi grassi saturi (SFA), come il palmitico e lo stearico, abbiano una tossicità per l’organismo mentre gli acidi monoinsaturi (MUFA), come l’oleico, la impediscano e ne favoriscano la detossificazione. (Tove S.B.1964, The Journal of Nutrition vol 84, n°3; 237-43)
Gli acidi grassi (FA) hanno un ruolo energetico e altre funzioni biologiche tra queste sono mediatori della segnalazione cellulare. Partecipano alla costruzione e funzionalità di alcune strutture, come le membrane cellulari, sede di recettori e di scambi intra-extracellulari, come i mitocondri, sedi del metabolismo, come le membrane del reticolo endoplasmatico (ER), sedi della biosintesi/maturazione dei lipidi e degli steroidi, sede d’immagazzinamento del calcio intracellulare, e non per ultima, della funzione detossificante.
In questi ultimi anni l’epigenomica e la metabolomica, hanno dimostrato, in diversi tipi di colture cellulari, che i FA si legano ai recettori della superficie cellulare (ad es. GPCR, recettori accoppiati alle proteine G) oppure a fattori di trascrizione intracellulare (come PPAR). In questo modo, l’oleico, si lega al recettore GPR40 aumentando la secrezione d’insulina quando questa è stimolata dalla presenza di glucosio.
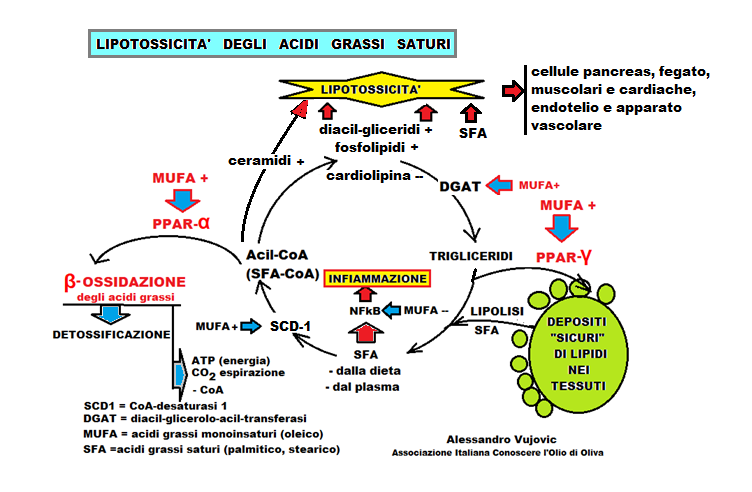
Queste indagini omiche hanno dimostrato che gli SFA sono citotossici in quanto:
– diminuiscono la fluidità della membrana cellulare alterando la funzionalità. Le membrane ricche di SFA formano isole meno fluide, inelastiche, rispetto a quelle con MUFA, come dimostrato da Yihui Shen et Coll. nel 2017 con la microscopia Stimolata di Scattering Raman, utilizzando SFA con atomi di idrogeno sostituiti con l’isotopo deuterio. (in Proc Natl Acad Sci USA; DOI: 10.1073/pnas.1712555114).
– Quando inclusi nei fosfolipidi dell’ER determinano uno stress con liberazione del calcio dai depositi che danneggia sia ER che i mitocondri. Quest’ultimi liberano il citocromo C ed attivano la via della caspasi con conseguente morte cellulare (lipoapoptosi).
– Un segnale, di morte cellulare, lo dà il calcio liberato dai depositi conseguente allo stress dell’ER che cambia il potenziale ossidoriduttivo dei mitocondri nonché l’attività degli enzimi che stabilizzano il ripiegamento delle nuove proteine sintetizzate dai ribosomi. In questo caso le proteine che assumono la struttura spaziale definitiva, se malripiegate si accumulano e determinano una tossicità con la conseguente morte cellulare. L’aggiunta di MUFA in una coltura cellulare, inibisce la lipoapoptosi, indotta dagli SFA.
– Gli SFA sono liganti meno potenti dei MUFA nei confronti dei recettori PPAR. L’attivazione di PPAR (α, β/δ, γ) da parte dell’oleico, promuove l’ossidazione degli SFA oppure il sequestro nella cellula, impedendo una loro successiva citotossicità. Il PPAR-α, quando attivato dall’acido oleico, induce la trascrizione dei geni, relativi agli enzimi, della β-ossidazione mitocondriale [meccanismo degradativo, fisiologico, a spirale, dei grassi dove, ad es., da una singola molecola di acido palmitico (C16:0) si formano 106 molecole di ATP, forma di energia chimica, e 16 molecole di anidride carbonica che vengono eliminate con l’espirazione), questo è anche un sistema detossificante per gli SFA. I MUFA, come l’oleico, attivano PPAR-γ che determina la captazione dei gliceridi-SFA e li immagazzina in modo da non danneggiare strutture come le membrane ER.
– La lipolisi dei depositi di trigliceridi libera SFA che, assieme a quelli provenienti dalla dieta, sono trasformati in Acil-CoA; di seguito i MUFA attivano PPAR-α che facilita la loro ossidazione enzimatica.
– Gli SFA sono meno ben incorporati nei trigliceridi, rispetto ai MUFA, poiché l’enzima DGAT (diacil-glicerolo-acil-trasferasi) incorpora preferibilmente le catene insature.
– Gli SFA, il cui destino non è lo stoccaggio (via PPAR-γ) o la beta-ossidazione (via PPAR- α), attivano il fattore di trascrizione nucleare NFkB che è un mediatore cardine degli stati pro-infiammatori, viceversa l’acido oleico l’inibisce. Difatti il NFkB è un fattore che può attivare l’espressione genica di 200 geni legati all’infiammazione con la produzione di molte proteine/enzimi infiammatori (ciclossigenasi, lipossigenasi, fosfolipasi, metalloproteinasi…) oppure geni che codificano citochine infiammatorie (IL-1, IL 2, IL 6, IL 8, IL12, TNF), o chemochine (MLP1, IL 18, MIP2, CXCL1, CXCL10), o molecole di adesione cellulare (ICAM e VCAM), o molecole che attivano i macrofagi (che a loro volta producono citochine pro-infiammatorie),o molecole che attivano i linfociti T, o molecole regolatorie del ciclo cellulare o molecole di radicali liberi dell’ossigeno.
– Gli SFA, per essere metabolizzati nella β-ossidazione, devono essere convertiti in acil-CoA (dove il gruppo acilico è la lunga catena dell’acido grasso, sia saturo che insaturo legato al coenzima A); il successivo passaggio, degli acil-CoA da SFA, è quello di diventare substrati per l’enzima di sintesi (DGAT); questo è il momento cruciale in cui gli SFA devono essere convertiti in una forma monoinsatura, come i MUFA, mediante l’azione dell’enzima CoA-desaturasi 1 (SCD-1). I MUFA, sperimentalmente, anche in una dieta ricca in SFA, inducono la sovraregolazione dei livelli di RNAm/SCD-1 che ha un’azione protettiva, permettendo la desaturazione del legame, portando alla metabolizzazione degli SFA.
– La tossicità degli SFA è anche dovuta all’aumento dei marker da stress cellulare ossidativo con sviluppo di radicali liberi dell’ossigeno (ROS), determinato sia dalla disfunzione mitocondriale sia dalla diminuzione di difese antiossidanti. Gli elettroni, persi dai complessi della catena di trasporto mitocondriale (Coenzima Q e citocromo C reduttasi), si combinano con l’ossigeno per generare ioni superossido, radicali idrossilici e perossidi d’idrogeno dannosi per le strutture cellulari per la citotossicità.
– L’apporto di SFA aumenta il diacilglicerolo e i ceramidi che sono citotossici mentre diminuisce la cardiolipina che stabilizza le membrane.

La ricerca ha dimostrato che gli SFA aumentano la citotossicità da stress ossidativo, infiammazione e apoptosi, i MUFA sono citoprotettivi. Vediamo ora i dati epidemiologici visto che gli SFA sono presenti in molti alimenti come la carne di manzo, maiale, oli vegetali come di palma e di cocco, burro di cacao, prodotti latteo-caseari, carni trasformate, snack preconfezionati e infine anche nell’olio di oliva (8-25%).
Il gruppo di lavoro di Russel J. de Souza (British Medical Journal 2015), analizzando 20.413 pubblicazioni, non ha trovato evidenze osservazionali tra maggior apporto di SFA e tutte le cause di mortalità, malattia cardiovascolare, mortalità e malattia coronarica cardiaca (CHD), ictus ischemico, diabete di tipo 2, tra soggetti adulti sani.
E’ stata trovata un’associazione, con un aumento del 28% di mortalità per CHD, 21% aumento del rischio di CHD, solo con alimenti contenenti ACIDI GRASSI INSATURI, con isomeria TRANS, DA TRASFORMAZIONE INDUSTRIALE e non da acidi grassi trans da alimenti naturali ovvero provenienti da animali ruminanti (carni bovine, ovine, caprine, latte e prodotti caseari…).
I ruminanti hanno, nel loro intestino, batteri, prevalentemente Butyrivibrio fibrisolvens, che bioidrogenano gli acidi grassi polinsaturi, in particolar modo il linoleico e linolenico, in isomeri trans mentre nell’organismo umano, e nell’EVOO, gli FA insaturi sono nella conformazione CIS. Gli enzimi cellulari trasformano efficacemente le molecole in conformazione cis, difficilmente in trans e in alcuni casi bloccano l’attività come la delta-6-desaturasi da cui derivano prostaglandine, leucotrieni ed eicosanoidi.
Gli FA trans, da trasformazione industriale, provengono da FA insaturi idrogenati, operazione eseguita per renderli meno ossidabili e per dare una consistenza semisolida (ad es. le margarine vegetali) e per il loro basso costo. Gli FA trans si formano anche durante la rettificazione dell’olio di oliva e nel riscaldamento, a temperatura elevata, come la frittura.
L’American Heart Association raccomanda che la dieta contenga lipidi tra il 25 e il 35% del totale delle calorie giornaliere, maggior parte come grassi insaturi e meno del 5% come grassi saturi.
Almeno 40 paesi hanno adottato misure specifiche contro gli ACIDI GRASSI TRANS, l’OMS consiglia un consumo inferiore all’1% del totale delle calorie giornaliere, mentre per la UE è ancora materia di discussione.